サイトメニュー
温泉や取材に関するお問い合わせは、
村杉温泉 風雅の宿 長生館
〒959-1928新潟県阿賀野市村杉4632-8
TEL 0250-66-2111/FAX 0250-66-2151
MAIL murasugi@chouseikan.co.jp
第二章「放射能泉の安全と健康」
山岡 聖典、鈴木 文男、安保 徹
(5)組織・個体レベルで見られる影響
臓器・組織の放射線感受性は、それらを構成している細胞の放射性感受性によって決まります2.10)。大人に比べて子供、さらには幼児や胎児は全身的に成長が著しく、将来行う細胞分裂が多い体細胞から成り立っているので放射性高感受性です。成人した後も、臓器・組織には未分化な組織幹細胞を中心として細胞再生系を維持しており、特に造血臓器(骨髄)や小腸、皮膚、水晶体、精巣(睾丸)は再生能が活発なので、放射線被ばくにより障害を受けやすくなります。実際に3~5Gyという比較的高線量の放射線を被ばくすると2カ月以内に骨髄損傷により50%の人が死亡します。消化管や肺および腎臓の障害は5~15Gyの線量で見られますが、前者の方が死亡に至るまでの期間が短いので、高線量被ばく者においてはまず末梢血液中の血球数の減少が起こり、次に下痢や消化不全の症状が見られ、続いて肺や腎臓の炎症が発生します。中枢神経系は極めて放射線低抗性であり、15Gy以上の被ばく直後から不快感、意識喪失を伴って数日以内に死亡することがあります。
これらはいずれも急性障害に分類され、一般に症状は被ばく線量が大きくなるほど重症化します。また、それぞれの症状が現れるまでの「しきい値線量(それ以下では発症しない線量)」が存在するので確率的影響とされています。図5に、ヒトの放射線影響の現れ方の概略を示します。これは、国際放射線防護委員会(International Commission on Radiological Protection:ICRP)が放射線防護上の立場から、放射線影響を確率的影響と非確率的影響(後に確定的影響に変更)に分けることを提言した勧告書(ICRP1977年勧告、Publication26)に従ったものです。さらに、被ばく者本人に関わる障害に加え、その影響が次世代そしてその子孫にまで及ぶ障害という観点から、身体的影響と遺伝的影響に分類しています。但し、マウス等を用いた研究から、放射線が線量依存的に生殖細胞に突然変異を誘発することは証明されていますが、原爆被爆者の子供たちについては、統計的に有意な染色体異常を含む遺伝的異常の増加は認められていないのが現状です。
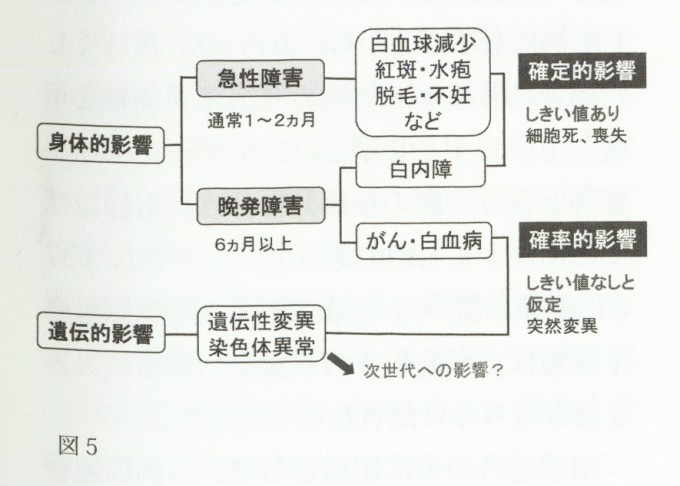
一方、がん等は被ばく後6カ月以上たってから発症するので、晩発障害として分類されています。すでに、がんは組織を構成する細胞の遺伝子変異が積み重なって悪性形質発現する、いわゆる「遺伝子病」の一種であることが証明されています。放射線発がんにおいても、線量に依存して種々のDNA損傷を引き起こし、例え損傷修復機構が働いたとしても修復エラーに伴う突然変異は避けられないので、その発生確率は被ばく線量に比例するものと考えられます。このような理由から、晩発障害に含まれる白内障を除いて、放射線被ばく者に生じる白血病や固形腫瘍は確率的影響とみなされています。以下に述べるように、いずれの悪性腫瘍も放射線被ばく者において発症リスクが上昇することから、各種の線量限度の設定において発がんリスクが最も重要視されてきました。現在では、安全を見越した放射線防護の観点から、この種の障害の発生率は「しきい値なしの直線仮説(linear no-threshold 仮説:LNT 仮説)」で説明され(ICPR Publication 99、2006)、原発事故時の避難地域の指定や飲食物接種制限を目的とした暫定規定値を設定する際にも用いられています11)。
DNA損傷に限らず、放射線被ばくにより組織・臓器に生じる障害は他の内的及び外的要因で生じるものと殆ど区別がつかないものです。また、病気としてのがんは個々人の遺伝的要因以上に、喫煙や食料、運動などの生活習慣や住んでいる地域・自然環境などによって発症頻度が大きく変わります。さらに、厚生労働省が発表している我が国の人工動態統計によれば、2009年にがんで死亡した人は全死亡者の約1/3、34万4千人に上りますので、放射線被ばくによるがん罹患者数の上昇が他の要因による変動を大幅に超えない限り、そのリスクを推定することは不可能です。この点を解決するために厳密に設定されたヒト集団を対象として、放射線被ばく(要因)とそれによるがん発症との因果関係を、統計学的に調査。解析する手法(疫学研究)が導入されるようになりました。
疫学研究においても最も大切な点は、信頼できるデータを得るために、如何にして大きなサイズの集団(コホート:固定集団)を設定するかにかかっています。この点、広島・長崎の原爆被爆者集団は規模が大きく(非被爆者約3万人を含む約12万人のコホート)、これに比類する放射線関連の調査対象集団は世界的にも皆無なので、極めて貴重なものです。また、被爆者個々人の被ばく線量に関しては、被爆当時の環境(気候や居場所)を基にy線及び中性子の透過係数について詳細な検討がなされ、日米両国研究者が参加して構築された原爆放射線被ばく線量評価体系2002(dosimetry system 2002:DS02)を基に、推定線量値として臓器ごとにつけられました
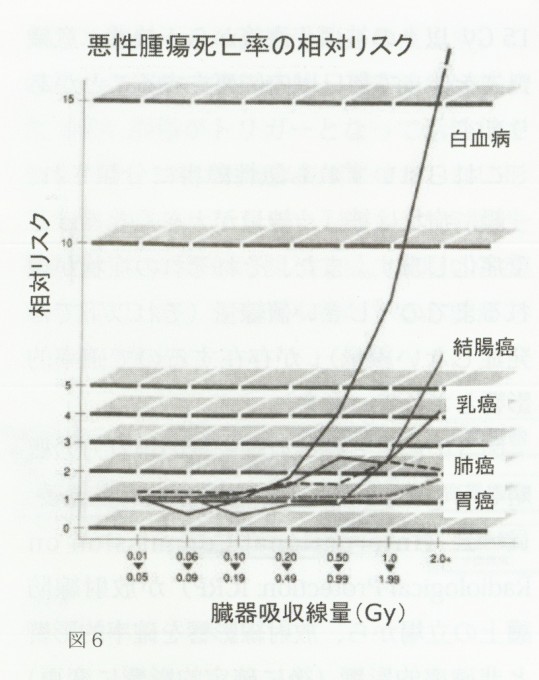
図6に、原爆被爆者の被ばく線量と悪性腫瘍による死亡率の相対リスクに関する疫学調査結果を示します12)。まず、各臓器の固形腫瘍に比べて白血病は圧倒的に発症しやすいことや、100mGy以下の線量では非被爆者と同程度か逆にがん死亡率が低下することがわかります。注目すべきは、何れの悪性腫瘍も被ばく時年齢が若い程発症率が高くなる事であり、また白血病は被爆後5~10年目をピークとしてその後急速に減少するのに対して固形がんの方は被爆後60年以上経過しても依然として増加傾向にある点です。
(6)低線量・低線量率放射線照射の影響
広島・長崎の原爆被爆者からなる寿命調査(LSS調査:life span study 調査)研究は、調 査対象の被爆者人数や推定された被ばく線量範囲及びその調査精度と期間において、他に例のない膨大なものです。最近取りまとめられた研究結果では、全固形がんを一つのグループとして見た場合、0~2Gyの範囲内において一貫してその過剰相対リスクに直線的な被ばく線量依存性があることが示されました13)。100mGy以下のデータに不確かさがあるにせよ、この結果は1,000mSv被ばくで発がんリスクが1.5倍になることから、100mSv被ばくした場合5%分固形がんが増える可能性を示唆しています。しかし、LSSデータは原子爆弾と言う一瞬の核爆発に伴う放射線被ばくに由来するものであって、セシウム137(半減期は30年)による長期間の低線量率y線被ばくが危惧される福島原発事故災害とはかなりかけ離れたものです14)。
国際連合の中に組織されている国際連合原子放射線影響科学委員会(United Nations Scientific Committee on the Effects of Atomic Radiation:UNSCEASR、2000年勧告)では、総線量200mGy以下を低線量、線量率0.06mGy/min以下を低線量率にすべきと勧告しています。既に述べたように、セシウム137由来のy線などの低LET放射線の場合、被ばく線量率が小さくなると生じたDNA損傷が効率よく修復され、結果的に突然変異誘発がん化形質発現に関わる遺伝子変異が低下することが知られています。実際にUllrich と Storerは、マウスを用いた放射線発がん実験において低線量率(0.06mGy/min)のy線照射では500mGy照射しても腫瘍発生が認められず、1000mGy(1Svに相当)以上でもその誘発効果は高線量率(450mGy/min)照射に比べて著しく低下することを報告しています15)。
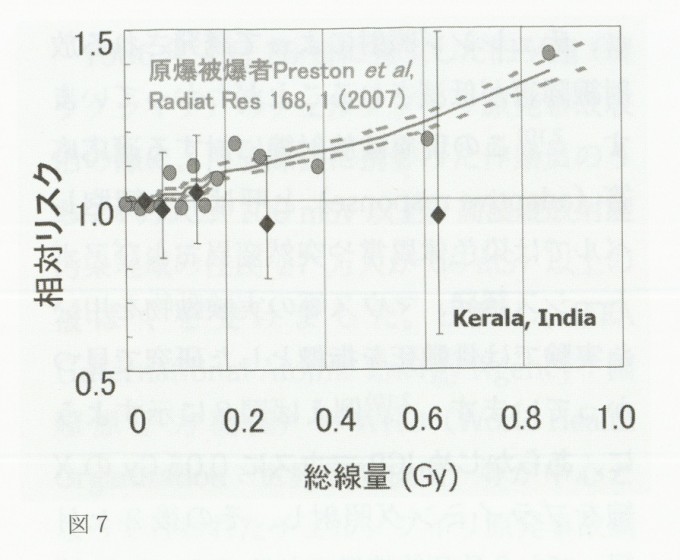
この様な実験動物を用いた研究に加え、発がんリスクに関する線量率効果については、自然放射線レベルの高い(高バックグランド)地域住民の疫学調査研究が参考になります。世界の自然放射線量は年間2.4mSvですが、天然に存在する長半減期のラジオアイソトープ量の違いによって、地域によっては3.8~260mSv/年という高い自然放射線量を示す所があります。しかし、これまでのがん発生に関する疫学調査では、高自然放射線地域住民に高頻度でがんが発生するという証拠は得られていません。例として、図7にインドの高バックグランド地域(3.8~35mSv/年)住民に関する疫学調査研究の結果を原爆被爆者のものと一緒に示します。インド・ケララ地方は天然放射性物質(トリウム)が多く含まれているため高バックグランドとなっています。しかし、この地域の住民のがん発生率は平均集積線量が最大0.628Gy(628mSv)の被ばく者集団であっても全く増加していないことが分かります。原爆被爆者の疫学調査研究では、100mSv以上の被ばくにより、線量依存的に固型がん発生率が上昇していますので、両者の違いは被ばく線量率が大きく異なることに起因しているものと考えられます。すなわち、原爆被爆者は一瞬の内に600mSvの放射線を浴びましたが、インド・ケララ地方の住民は被ばく線量率(35mSv/年=約4X10-3mSv/h)が極めて低いため、同じ線量を浴びるのに約17年もかかっているのです。
(7)低レベル放射線に対する生体応答
すでに、細胞はDNA損傷に対して巧妙な応答反応を示すことを述べてきました。この現象は生体防御機構の一種であり、特に中~低線量域の放射線を被ばくした場合には、高線量・高線量率で引き起こされる生物学的影響に比べてより抑制的に働くことになります。実際に、あらかじめ低い線量の放射線を照射(プラミング照射)したあとで一定の生物影響を引き起こす高線量の放射線を照射(チャレンジ照射する)とチャレンジ照射によって誘発される放射線障害が低減されることがわかっています。2)10)この現象は放射線に対する適応応答(adapotive response)と呼ばれ、細胞レベルでは染色体異常や突然変異およびアポトーシス誘発、マウス等の実験動物を用いた実験では骨髄死を指標とした研究で見つかっています。2)10)例えば図8に示すように、あらかじめICRマウスに0.05GyのX線をプライミング照射し、その後2ヶ月経ってから致死的線量である8GyのX線をチャレンジ照射すると、マウスの生存率が有意に上昇することが報告されました。
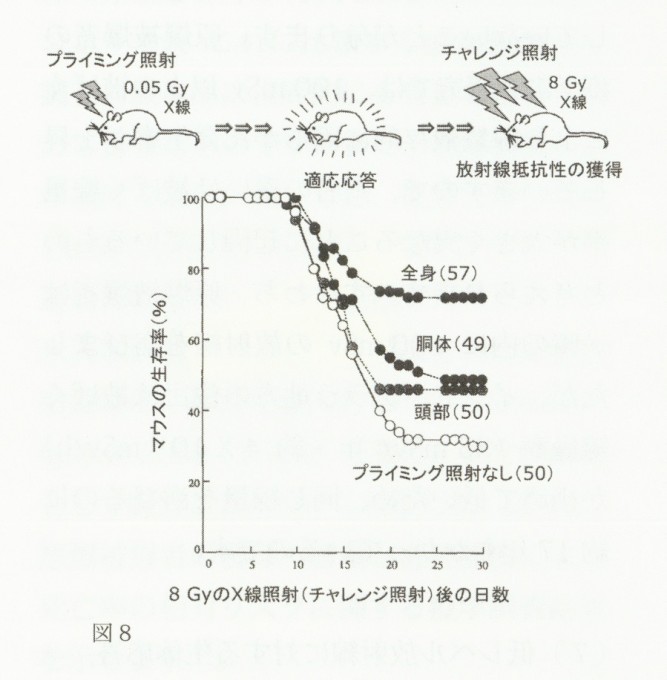
この実験では、マウスを3.2mm厚の鉛板で全身あるいは部分的遮蔽してX線をプライミング照射し、8Gyのチャレンジ照射後30日目までについてマウスの死亡数を計測しています。興味あることに、全身照射に加え、胴体や頭部照射だけでも放射線に対する適応応答現象が見られることがわかります。
このような放射線の有益効果は、古くは、極低レベル放射線照射による動植物の成長促進を目指した研究や、マウスやラット等の実験動物を用いた放射線による免疫系の活性化に関する研究において見つかっています。18)さらに米国ミズリー大学のLuckeyは、広島・長崎原爆被爆者の放射線影響調査データを詳細に検討した結果、先天性異常や白血病の発生および死亡率(寿命短縮)は、それぞれ100,260および60mSv以下17)ではいずれも非被爆者に比べて低下すると結論づけています。19)これらは「放射線はどんなに微量でも人の健康に悪影響を与える」とする放射線防護上のLNTモデルに反するもので、低レベルであれば放射線はむしろ何らかの有益な効果があることを示すものです。1980年にLuckeyは、この現象を放射線ホルミシスと命名しています。
わが国では古来、ラジウム温泉などの放射能泉が健康増進のため利用されてきました。三朝温泉では温泉旅館の客室中でラドン(半減期が1600年のラジウム226に由来する半減期3.8日のラドン222)濃度が100~530Bq/m3、温泉地区の大気中で26Bq/m3であり、全国一般家屋内での濃度15.5Bq/m3に比べて高い値になることがわかっています。また、三朝温泉地区とその周辺農村地域の住民について、長年調査研究を行った岡山大学病院三朝医療センターの研究グループからは、がん死亡率の全国平均を1とした場合、周辺地域の男性が0.85で女性が0.77更に三朝温泉地区では男性が0.55で女性が0.46とかなり低くなることが報告されました。20)
もし、三朝温泉住民の低いがん死亡率が、主としてラドンガスの吸入による極低線量率のα線被ばくに起因するならば、この疫学調査結果はα線にホルミシス効果があることを示唆したものといえます。しかし、この研究も含め、初期の放射線ホルミシスとして報告されている論文の多くは、疫学調査研究を左右する集団(コホート:固定集団)サイズが不十分であり、しかも被ばく者個々人の被ばく線量が曖昧なうえに、限られた期間での住民の人口動態を中心とした調査研究に基づくものです。低レベル放射線被ばくがどの程度のホルミシス効果を有するかについては、これらの点をクリアしたうえで再度検討する必要があります。
おわりに
2011年3月11日に発生した東日本大震災に伴う東電福島第一原発事故により、周辺の地域に深刻な核分裂生成物による環境汚染を引き起こし、長期的な低レベル放射線による健康影響が危惧されています。世界で唯一の原爆被爆国である日本では、原子力災害の主役として放射能や放射線を過剰に危険視する風潮が生まれやすく、被災地域を中心として根拠のない情報に基づく数々の風評被害が止まりません。確かに、y線等の放射線は透過性があり、僅かなエネルギーで重篤な被害を及ぼす反面、致死に至るような線量を被ばくしても五感では感じられないという怖い性質を有しています。しかし、私たちは自然界に微量ながら存在する放射性物質からの放射線や宇宙線の被ばくを受けながら生きており、また古くから病気治療療養のためにラジウム温泉が利用され、「微量の放射線であればむしろ人の健康に役立つ」とする考え(放射線ホルミシス効果)が受け入れられているのも事実です。
986年4月26日に発生した旧ソ連(現ウクライナ)のチェルノブイリ原発事故収拾の際に、汚染除去に携わった作業員のうち24万人が100mSv以上、高濃度放射能汚染地域の住民27万人が50mSv以上の被ばくを受けました。しかし、IAEA(International Atomic Energy Agency:国際原子力機関)やWHO(World Health Organization:世界保健機関)等が中心となって行われたチェルノブイリ原発事故調査研究では、放射線影響が認められたのは入院した234の内134人の急性放射線障害(その内3ヶ月以内に28人が死亡)と汚染ミルクの服用により14歳以下の子供に発生した甲状線がん(約4,000人以上)だけであり、白血病を含めたその他の疾患の増加については確認できないと結論されました。21)
近年明らかにされたように、放射線被ばく細胞に巧妙なDNA損傷修復や細胞応答機構が存在すること、さらに世界の高自然放射線地域住民に統計的に有意ながん発生率の上昇が見られないことは、ある一定線量(しきい値線量)以下であればがんなどの障害が除かれる生体防御機構が有効に働くことを示すものです(図9)。
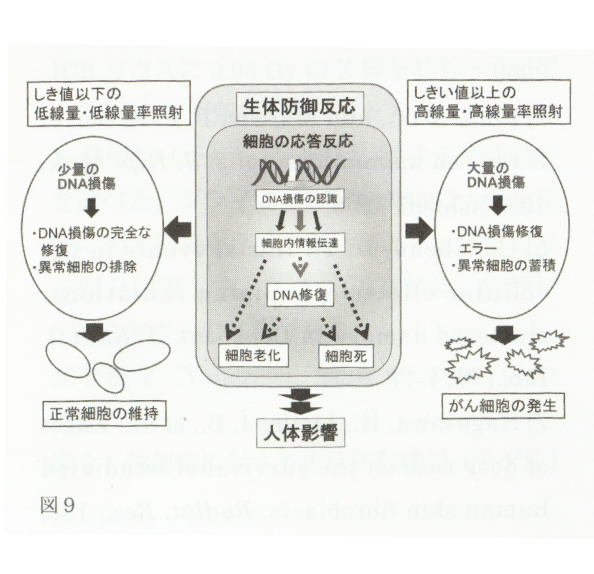
このことはまた、放射線防護の分野で用いられている「LNT仮説」が、必ずしも低線量・低線量率被ばくの場合には適応できないことを示唆します。18)生命科学の発展に伴い、放射線の生体影響に関する分子レベルでの生物・医科学的な機構解析が可能になっていますので、多方面からの信頼できる学術的情報を基に低線量・低線量率放射線の発がんリスクについて再検討し、より安全で合理的な放射線防護に関する各種の基準線量を設定することが急務となっています。
引用文献
- 1)鈴木文男:放射線の生物影響(基礎研究の現状と展望)、長崎医学会雑誌、85(特集号)、149-163,2010.
- 2)Hall,J.H.,and Giaccia,A.J.:Radiology for the Radiologist, 7th ed. Lippincott Williams and Wilkins,2012.
- 3)Lea, D.E.:Actions of radiations on living cells. CambridgeUniv.Press,Cambridge,1946.
- 4)Misteli,T.,and Soutoglou, E.,The emerging role of nuclear architecture in DNA repair and genome maintenance. Nature Reu.Mol.Cell Biol., 10,243-254,2009.
- 5)Puck,T.T.,and Marcus,P.I.:Action of X-rays on mammalian cells. J.Exp.Med.,103,653-666,1956.
- 6)Goodhead,D.T.:Initial events in the cellular effects of ionizing radiations:clustered damage in DNA.Int.J.Radiat.Biol.,65,7-17,1994.
- 7)Nagasawa,H.,Little,J. B.,et al.;Effect of dose rate on the survival of irradiated human skin fibroblasts.Radiat.Res.,132,375-379,1992.
- 8)Painter,R.B.,and Young,B.R.:Radiosensitivity in ataxia-telangiectasia:A new explanation.Proc.Natl.Acad.Sci.USA,77,7315-7317,1980.
- 9)Lavin,M.F.:Ataxia-telangiectasia:from a rare disorder to a paradigm for cell signaling and cncer.Nature Reu.Mol.Cell Biol.,9,759-769,2008.
- 10)菅原務監修、青山喬編著:放射線基礎医学、第9版、金芳堂、2000.
- 11)ICRP 勧告翻訳委員会訳:放射線関連がんリスクの低線量への外挿、ICRP Publication 99、2006、日本アイソトープ協会、2011.
- 12)重松逸造他編:原爆放射線の人体影響、1992要約版、文光堂、1993.
- 13)Preston,D.L.,Ron,E.,et al.:Solid cancer incidence in Atomic Bomb survivors、1958-1998.Radiat.Res.,168,1-64,2007.
- 14)鈴木文男:放射能の健康への影響-放射線のヒト細胞・組織に与える障害-(福島原発事故の検証と環境放射能汚染 第6章)、資源環境対策、47(別冊)、85-100,2011.
- 15)Ullrich,R. L.,and Storer,J.B.:Influence of yirradiation on the development of neoplastic disease in mice.III.Dose rate effects.Radiat.Res.,80,325-342,1979.
- 16)Nair,R.R.K.,Rajan,B.,et al.:Background radiation and cancer incidence in Kerala,India-Karunagappally cohort study. Health Phys.,96,55-66,2009.
- 17)Yonezawa,M.,Misonoh,J.,and Hosokawa,Y.:Two types of X-ray-induced radioresistance in mice Presence of 4 dose ranges with distinct biological effects.Mutation Res.,358,237-243,1996.
- 18)佐藤敏彦:放射線は本当に微量でも危険なのか?-直線しきい値なし(LNT)仮説について考える、医療科学社、2012.
- 19)Luckey,T.D.:Atomic bomb health benefits. Dose-Response, 6,369-382,2008.
- 20)Mifune,M.,Sobue,T.,et al.:Cancer mortality survey in a spa area (Misasa, Japan)with a high radon background.Jpn.J.Cancer Res.,83,1-5,1992.
- 21)長瀧重信:放射線の人体に対する影響(科学的に正しい理解のために)、第4回、Isotope News 8月号、22-27,2009.
プロフィール
鈴木文男 広島大学名誉教授
1969年立命館大学理工学部卒業(1979年理学博士、京都大学)同年金沢大学薬学部助手。講師、助教授を経て1996年広島大学原爆放射線医科学研究所教授。2005年同研究所長。2010年より名誉教授。第3回北国がん基金助成賞(1989年)など。専門分野は放射線生物学、放射線の生物影響に関する細胞生物学的及び分子生物学的研究。近著に『放射線の生物影響(基礎研究の現状と展望』(長崎医学会誌85巻特集号)(単著)『福島原発事故の検証と環境放射能汚染』(共著)など。
図の説明
図1 放射能と放射線に関する単位
図2 放射線により誘発されるDNA損傷
図3 DNA二本鎖切断に対する修復機構
主要修復システムとしてDNA相同組み換え(Homologous Recombination:HR)とDNA非相同末端結合(Non-Homologous End-Joining: NHEJ)が働いている。原著論文(Downs,J.A.et al .2007)より改変。
図4放射線誘発DNA損傷に起因する生物影響の発現過程(新モデル)DNA損傷修復に加え、腫々の細胞応答反応が放射線の生物影響に深く係わっている。
図5ヒトに対する放射線影響の分類
図6原爆被爆者に発生した悪性腫瘍
1回の原爆放射線被ばくにより、被ばく線量に依存して種々の悪性腫瘍による死亡が増加した。発症するまでの期間(潜伏期)は悪性腫瘍によって異なり、白血球は1950年、甲状腺癌は1955年、乳癌と肺癌は1956年、胃癌及び血腸癌骨髄腫は1975年以降から見られた。
参考文献(重松逸造他編、1973)より改変
図7 インド高自然放射線地域住民の健康リスク
原爆被爆者の場合(●)100mS以上では被ばく線量依存的に全固形がんの発生頻度が上昇しているが、インド・ケララ州住民に関しては(□)平均集積線量が最大628mSvの被ばく者集団においても、有意な固形がんの増加は観察されなかった。
講演資料(酒井一夫、2010年)を参考に、原著論文(Nair,R.R.K.,et al.,及びPreston,D.L.,et al.2007)より改変
図8 マウスで観察された放射線適応応答現象
ICRマウスに0.05GyのX線を前もって照射(プライミング照射)し、2ヶ月後に8GyのX線照射(チャレンジ照射)による致死効果を調べた。プライミング照射時には、全身照射に加え鉛板を用いて胴体部あるいは頭部だけを部分照射した。( )内の数値は、実験に用いたマウスの匹数である。
原著論文(Yonezawa,M.,et al.,1996)より改変
図9 放射線に対する生物防御機構(モデル)



