サイトメニュー
温泉や取材に関するお問い合わせは、
村杉温泉 風雅の宿 長生館
〒959-1928新潟県阿賀野市村杉4632-8
TEL 0250-66-2111/FAX 0250-66-2151
MAIL murasugi@chouseikan.co.jp
第二章「放射能泉の安全と健康」
山岡 聖典、鈴木 文男、安保 徹
低レベル放射線の健康影響に関する基礎知識
鈴木 文男(広島大学名誉教授)
はじめに
近年の遺伝子解析を中心とした生命科学・分子生物学研究の進歩により、放射線の生物影響研究も「DNA損傷修復に関わる生体分子の同定とその機能解析」を中心として急速に発展してきました。最近では、生体を構成する各細胞には放射線で生じた、DNA損傷を効率良く修復するだけでなく、損傷に対して自ら応答することにより異常細胞の出現を防止していることが判明しています1)。また、低線量放射線を被爆した細胞は、その後の高線量放射線照射に対して抵抗性を獲得する現象(放射線適応応答現象)がみられることから、刺激を受けた細胞には放射性誘発DNA損傷をより効率良く修復するための自己防御システムがあるものと考えられています。
本稿では、まず放射能や放射線作用に関する基本知識を紹介し、次にこれまで得られた「放射線誘発DNA損傷修復」や「DNA損傷に対する細胞応答」及び「低線量放射線影響」に関する研究結果を披露し、最終的にはこれらの学術情報をもとに、低レベル放射線の健康影響について概説します。
(1)放射能と放射線について
環境中には原子核がひとりでに放射線を出して他の原子核に変わる不安定な元素があり射性同位元素(ラジオアイソトープ)とよんでいます。このラジオアイソトープが他の種類の元素に変わる(この現象は壊変とよばれる)頻度を放射能といい、その時に放射線が放出されます。この点、よく放射能もれとか放射能の健康影響といった言葉が使われますが、正確には放射性物質もれとか放射線の健康影響というべきです。各ラジオアイソトープは固有の半減期(原子数がもとの半分になるまでの時間)を持っており、自然界には微量ながら極めて長い半減期を有するラジオアイソトープが存在します。例えば、順次壊変してラドンやラジウム等のラジオアイソトープを作るウラン238(半減期は約45億年)やトリウム232(半減期は約141億年)、及び1回の壊変で安定化するカリウム40(半減期は12.8年)がその代表です。
このようなラジオアイソトープを含む天然の放射性物質からの放射線(自然放射線)は、診断・治療用に使われるX線や荷電粒子線などの人工放射線と違って生涯にわたって避けられない放射線被爆の原因となります。その内カリウム40の影響はもっとも基本的なものです。すなわち、カリウムは必須ミネラルで全体重の約0.2%含まれ、その0.012%がカリウム40ですから、体重60㎏のヒトであれば約14㎎のカリウム40(約4,000Bqの放射能に相当、後記)を常に蓄え、強いβ線(1.31MeVなど)やy線(1.461MeVなど)による内部被爆を受け続けることになります。また、ウラン235の核分裂反応を利用した原子力発電では放射性ヨウ素(例えばヨウ素131や133)やセシウム137等の核分裂生成物が原子炉内に蓄積し、事故により環境中にもれると長期間にわたる外部被ばくや内部被ばくの原因となります。
ラジオアイソトープから放出される放射線は、粒子であるα線(本体はヘリウムの原子核)とβ線(本体は電子)、および高エネルギー電磁波のy線です。粒子線のうちα線は2荷の電荷を持っているので、吸収物質中を高密度で電離し、単位飛跡あたりの放出エネルギー(線エネルギー付与:Linear Energy Transfer :LET)が大きく高LET放射線と呼ばれています。X線は加速された電子線などを用いて得られる高エネルギー電磁波で、y線と同様に吸収物質を相互作用して低頻度ながら電離作用を引き起こします。(y線とx線は低LET放射線)。その結果、α線は空気中数㎝しか飛ばないのに対して、β線は空気中で数mまで届くので、遮蔽するには金属板やプラスチック板で囲む必要があります。Y線やx線は高エネルギーの電磁波なので、透過性が高く完全に遮蔽するために数cm以上の厚さの鉛板や重コンクリートが用いられます。
図1に放射能と放射線に関する単位を示します。まず、その物質の放射能は含まれるラジオアイソトープの壊変頻度で表されます。単位はBq(ベクレル)であり、1Bqは1秒間に1壊変する放射能に相当します。放射線の生体影響を評価するためには、2種類の単位が用いられています。吸収線量の単位Gy(グレイ)は放射線被ばくによって生体物質の単位質量当たりに吸収されたエネルギー量で示されます。すなわち1Gyは、生体物質1kg当たり1ジュールのエネルギーが与えられた時の吸収線量です。しかし、同じ吸収線量を被ばくしても放射線の種類によって各組織・臓器への影響が異なりますので、放射線の影響度(放射線荷重係数)で補正した等価線量が必要となるばかりか人体への影響については各組織・臓器への影響を合計した実効線量で評価されます。等価線量と実行線量の単位はともにSv(シーベルト)ですが、実行線量は等価線量に各組織の影響度(組織荷重係数)が加味されている点において、より放射線防護の立場にたった放射線使用の安全・管理を行うために定められた単位といえます。
(2)放射線作用の特徴
1985年にR öntgenがX線を発見して以来、診断・治療への放射線の利用が急速に進むと同時に、X線使用者に皮膚炎や白血球減少などの急性障害が多発するようになり、古くからその発達障害発生機構の研究が行われてきました。一方で、極少量のエネルギーでも重篤な障害を及ぼす特徴を利用して、放射線は生命現象を解き明かすための広範囲な基礎研究に用いられてきました。例えば、1906年にフランス人医師のBergoniéとTribondeauは、ラット精巣にy線照射し、細精管中の細胞の成熟・分化の過程と障害とを詳細に解析して①細胞分裂頻度の高いものほど、②将来行う細胞分裂の大きいものほど、③形態、機能が未分化なものほど放射線に対して感受性が高いことを明らかにしました。これは、ベルゴニー・トリボンドーの法則として知られ、生体組織・臓器を構成する細胞の放射線感受性の基本的性質を端的に示したものとして、現在でも放射線の診断や治療を行う際の基本的な指針となっています。
ところで、放射線の吸収線量は吸収されたエネルギー量で表されるため、放射線障害を火傷と同じように考えがちです。しかし、たとえ全身被ばくにより2カ月以内に50%の人が亡くなるような線量であっても、受けたエネルギーは60℃のコーヒーをわずか数ml飲んだ程度にしかなりません2)。これは放射線による障害は熱による生体分子の変性によるのではなく、標的である細胞内の核、特に感受性の高い核DNA(標的分子はゲノム DNA)が直接電離されたり(直接作用)、水の放射線分解によって生じたラジカル(特にOHラジカル)によって傷がつくこと(間接作用)により引き起こされるためです。実際にLeaは、ウイルスを用いた放射線照射実験のデータをもとに、ウイルスの不活性化線量値Doから標的分子量を計算し、その微小領域の質量が一本鎖の核酸質量と一資することを証明しています3)。放射線の主な共通した性質は電離作用であり、標的分子であるDNAに特異的に損傷を与えます。その結果、放射線被ばくした場合、①ある程度の線量を被爆しても五感(視覚・聴覚・嗅覚・味覚・触覚)では認識できない②高線量被ばくすると1~2カ月2)以内に種々の症状が現れる(急性障害)③中・低線量被ばくでは数カ月あるいは数年~数十年経てから障害が現れる(晩発障害)という特徴を示します。
(3)放射線誘発DNA損傷と修復
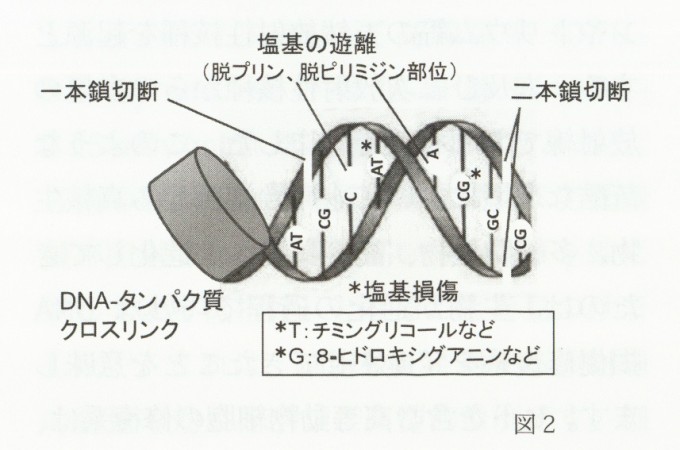
生物の全遺伝情報をつかさどる分子は2本の細長い鎖が塩基対で結合したゲノムDNAです。遺伝子情報はDNA中に4種の塩基(A:アデニン、T:チミン、G:グアニン、C:シトシン)の並びによって描かれ、糖とりん酸からなる2本の骨格がアデニンとチミン、グアニンとシトシンが水素結合することによって作られた二重らせん構造の中に保存されています。ヒト細胞ではわずか直径5μmの核内に2m近くのDNAが複雑に折りたたまれて存在するので、放射線被ばくを受けると容易にその構造が壊されます。図2には、細胞が放射線を被ばくした場合に生じる主なDNA損傷を示します。
放射線によるDNA損傷の種類は100以上報告されていますが、大別して鎖切断、塩基の遊離、塩基損傷およびクロスリンクに分離できます。まず、本稿で記載している放射線とは、電離作用を有する粒子線(α線、β線)や高エネルギー電磁波(y線、X線)などで、放射線被ばくすると容易に片方のDNA鎖が切れたり(一本鎖切断の生成)、両方とも切れる(二本鎖切断の生成)だけでなく、塩基部分が鎖から切り離され、脱プリンや脱ピリミジン部位が生じます。また、DNAをとりまく水分子に生成したOHラジカルによっても同様の損傷が誘発されるとともに、OHラジカルが各塩基の特定部位と反応してチミングリコールや8-ヒドロキシグアニン(直ぐに8-オキソグアニンに変化)などの酸化的塩基損傷を作ります。一方、核内ではDNAはヒストリンなどのタンパク質と結合して存在するので、両内高分子が結合したクロスリンク反応が起きます。
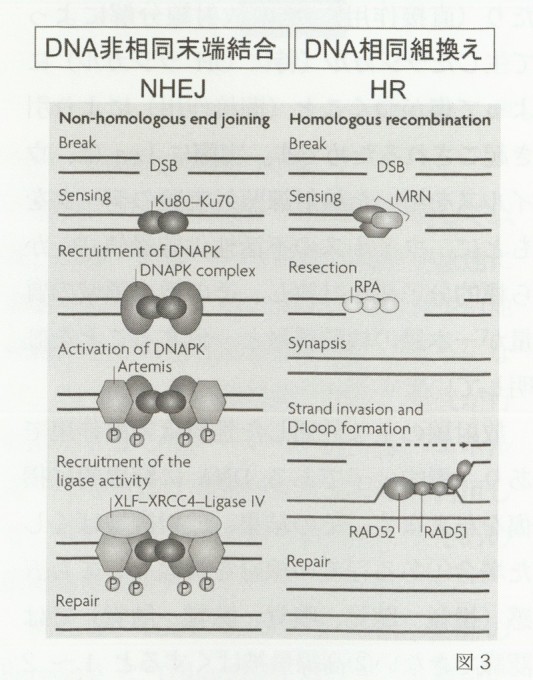
これらのDNA損傷の内、DNA二本鎖切断は最も重要なものです。二本とも切れた状態では遺伝子情報の致命的な消失となり、また遺伝子複製の際に重大な障害を引き起こし、結果的に細胞死や突然変異の原因となります。38億年前に生命が誕生したころの地球は、強い宇宙線に加え、ウランやトリウム等の天然放射性核種を起源とする一次及び二次放射性核種からの多量の放射線でおおわれていました。このような苛酷な環境においても原始細菌から真核性生物、多細胞生物、高等生物へと進化してきたのは、生物が進化の過程で巧妙なDNA損傷修復系を発達させてきたことを意味します。ヒトを含む高等動物細胞の修復系は、DNA相同組み換え(Homologous Recombination:HR)とDNA非相同末端結合(Non-Homologous End-Joining:NHEJ)に大別され、これまでの分子生物学手法を用いた機構解析により、各修復経路に関与する因子の同定とその機能が次々と明らかになってきました4)。
図3に示すように、HRは相同もしくは姉妹染色体上の相同配列DNAとの組換え反応であり、NHEJは切断されたDNA末端同士が再結合する機構です。最初の反応は、生じたDNA二本鎖切断を感知するステップであり、HRでは複合タンパク質MRN(Mre11/Rad50/NBS1)、NHEJでは、Ku70-Ku80ヘテロダイマーがその役割を果たします。HRではDNA切断端の切除反応(replication proteinA:RPA)が関与を経て組換え修復に関与するRad51、Rad52、Rad54などのタンパク質が働き、NHEJではDNA-PKcs,XLF,XRCC4及びligaseIVによってDNAの再結合が完了します。生じたDNA二本鎖切断の両末端同士を再結合させる場合、人重症複合免疫不全症(Scid)の原因遺伝子としてクローニングされたArtemis等の働きにより切り揃える必要があり、その結果NHEJでは染色体の欠失変異や転座を伴うことが多く、HRに比べてエラーの多い修復システムとなります。
(4)細胞レベルで見られる影響
組織培養技術の発達により、がん細胞や増殖の活発な正常細胞については、生存能を細胞の集落(コロニー)形成を指標として調べることが可能となっています。PuckとMarcusは、ヒト子宮頚部がん由来のHeLa細胞に種々の線量のX線を照射し、未照射細胞と照射細胞の形成したコロニー数の比(生存率)からHeLa細胞の線量-生存率曲線を求め、世界に先駆けてX線の細胞致死効果が標的理論で説明できることを証明しました5)。
表1は、1GyのX線やy線を照射した場合に生じるDNA損傷と、種々の生物学的効果を取りまとめたものです6)。この表により、これらの電離密度の低い低LET放射線では、1Gyで細胞核内に約10万個もの電離が生じることがわかります。その内、遺伝子情報を担うDNA分子内に約2,000個の電離が引き起こされ、その後の生化学的反応を介してDNA一本鎖切断として1,000カ所、全塩基損傷が950個、そして致命的な傷であるDNA二本鎖切断が40個生成されます。しかし、この様に多量のDNA損傷が生じても、実際には20%から80%の細胞が生存できる事から、細胞はかなり効率よくDNA損傷を修復することが分かります。ただし、1Gyの低LET放射線の被ばくをうけると1遺伝子座あたり約10-5の頻度で突然変異が誘発されることから、DNA損傷修復にはエラーを伴うので、もし細胞がん化形質発現に関わる遺伝子変異が蓄積すると、原爆被爆者に見られるようながん発症に繋がる可能性があります。

古くから、同じ線量照射してもX線やy線よりα線などの高LET放射線の方が細胞致死効果が高いことが判明しています。これは、高密度に電離する高LET放射線では、修復されにくい広範囲にわたるDNA損傷(クラスター損傷)や複雑なDNA切断が生じることに起因しており、線質効果と呼ばれています。また、低LET放射線では照射線量率(単位時間当たりに照射する放射線量)を下げると、生じたDNA損傷に対して修復系が働きやすくなるため、細胞致死効果が低下します。例えば、NagasawaらはDNA損傷修復能を有するヒト皮膚由来初代培養細胞を分裂停止状態に培養・維持し、それぞれについて高線量(0.70-0.75Gy/min)或いは低線量率(0.38-2.55mGy/min)のy線を照射したところ、6種の細胞とも高線量率照射に比べて低線量率照射ではいずれも高い生存率(y線に対してより抵抗性)となることを見つけました7)。これは、細胞致死に対する放射線の線量率効果を示した典型的な例です。細胞致死を、指標として見られた線質効果と線量率効果は、実験動物を用いた放射性発がんや遺伝的影響研究でも報告されているので、これらは放射線作用の特徴的な現象であり、ヒトに対する放射線影響を考える上で最も重要な要因となります。
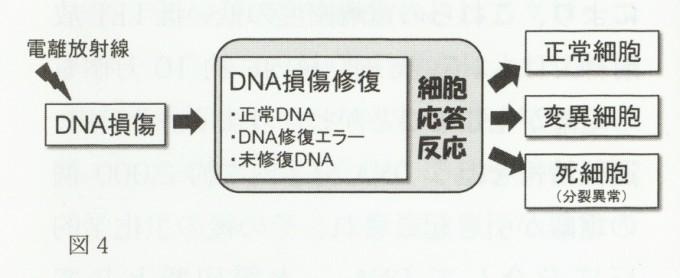
放射線生物学では、放射線照射により現れる複雑な生命体の反応を定量化することに成功し、「放射線の生物影響は、基本的には生じたDNA損傷量とその細胞の修復能に依存する」とする「標的理論」が確立されました。しかしながら、最近では細胞内シグナル因子の同定とその機能解析を中心とした分子生物学的研究から、放射線の生物影響にはDNA損傷に対する細胞応答(DNA-damage resposnse:DDR)反応が深く関わっていることが明らかになってきました1.2.4)。実は、放射線の生物影響がDNA損傷修復だけで語れないことは、30以上年前にヒト放射線高感受性遺伝病である毛細血管拡張性運動失調症(ataxiatelangiectasia:AT)患者由来細胞を用いて行われたPainterとYoungの研究結果から示唆されていました8)。彼らは、患者由来のAT細胞が正常細胞に比べて低いX線生存能を示す反面、放射線照射によるDNA合成抑制効果に対しては抵抗性であることを見つけたのです。その後ATの原因遺伝子(ATM)がクローニングされましたが、意外にもATM(ataxiatelangiectasia-mutated protein kinase)はDNA損傷修復酵素ではなくDNA損傷により活性化される主要な細胞内シグナル因子でした9)。現在では、AT細胞の場合G1期からS期及びS期の進行抑御(「細胞周期チェックポイント」制御)に欠陥があり、進行ストップがかからず損傷を持ったままDNA合成(異常なDNA合成)することにより放射線高感受性になっているものと考えられています1.2.4.9)。
培養細胞を用いた研究により、細胞死が細胞の種類によって放射線被ばく後に細胞分裂を介さずに生じる速やかな死(間期死)と何回か分裂して死滅する増殖死に分けられることが分かっています2.10)。この内、放射線高感受性の胸腺細胞や小腸クリプト細胞などは、典型的な自爆的細胞死(アポトーシス)の形態を示します。特に、正常のp53遺伝子を有する細胞では、放射線誘発DNA損傷によりp53が安定化して細胞内に蓄積し、アポトーシス誘発に関わる細胞内シグナル伝達経路が活性化されるので、アポトーシス高感受性となります。このような細胞応答反応は、基本的には生じたDNA損傷がトリガーとなって活性化されるのでDNA損傷修復能に依存しない形で生物影響を及ぼします。即ち、放射線生物影響 の発現過程に関しては、細胞応答反応を加えた新しいモデルをたてる必要があります(図4)。